随着生物技术和分子医学的快速发展,通过引入mRNA作为疫苗或治疗药物,在人体体内几乎能够生产任何所需功能蛋白/肽。这代表了一个日益上升的精准医学领域,在预防和治疗许多棘手的或遗传性疾病方面具有巨大的前景。科学家们一直希望优化mRNA稳定性、免疫原性、翻译效率和递送系统,以实现mRNA的高效和安全递送。
信使RNA(mRNA)是一种从DNA链转录而来的单链核糖核酸,它携带蛋白质合成的编码信息。体外转录(IVT)mRNA在小鼠骨骼肌细胞中成功转录和表达,建立了mRNA治疗的可行性。当mRNA可以成功转染,并通过直接注射到小鼠体内以表达治疗性蛋白,以剂量依赖的方式产生免疫反应时,人们提出了基于mRNA的治疗方法[1]。与基于DNA的药物不同,mRNA转录本具有相对较高的转染效率和较低的毒性,因为它们不需要进入细胞核即可发挥功能。最重要的是,mRNA没有意外感染或机会性插入突变的潜在风险。与传统瞬时蛋白质/肽药物相比,mRNA能够持续翻译蛋白质/肽,因此在治疗相关疾病方面具有广泛的潜力。
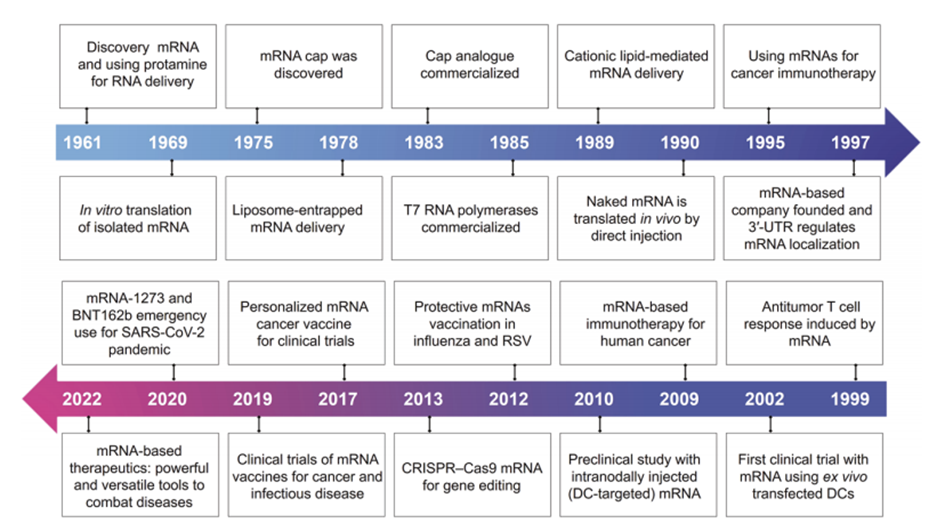
图1 基于mRNA的治疗方法的关键发现和进展
01 mRNA药物的一般设计方法
mRNA的设计和合成是mRNA药物的关键步骤。mRNA具有5个功能区域,包括5’端帽状结构、5’端非翻译区(UTR)、开放阅读框(ORF)和3’端非翻译区和3’端poly(A)尾状结构,它们介导了mRNA的翻译效率和衰变率。
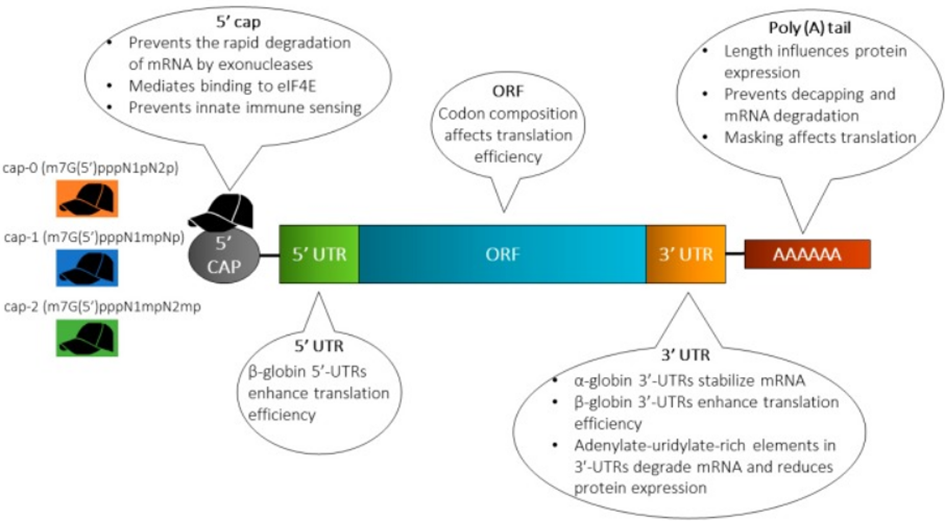
图2体外转录(IVT) mRNA的结构及常用修饰策略[2]
5’帽:5‘帽位于mRNA的5’端,甲基化程度不同。在真核生物中,5’帽(m7G ppp)含有7-甲基鸟苷(m7G),通过5’-5’三磷酸桥(ppp)连接下一个核苷酸。在翻译起始阶段,该帽通过m7G的疏水阳离子-π相互作用和三磷酸桥的负静电电荷结合了eIF4E。去除该帽时,三磷酸桥是真核细胞中主要的靶标mRNA脱帽酶。因此,许多mRNA结构优化策略已被用于优化m7G或三磷酸桥,以实现对eIF4E具有高亲和力和对脱帽酶具有低敏感性的帽状类似物。
poly (A)尾巴:多聚(A)尾通常由10-250个腺嘌呤核糖核苷酸组成。Poly (A)尾巴是mRNA的动态添加,其长度在调节mRNA翻译效率和蛋白表达中起着重要作用。在机制上,3’端poly (A)尾巴与PABPs结合,随后通过翻译起始因子eIF4G和eIF4E与5’帽相互作用,促进了一个“闭环结构”,调节mRNA的翻译效率。
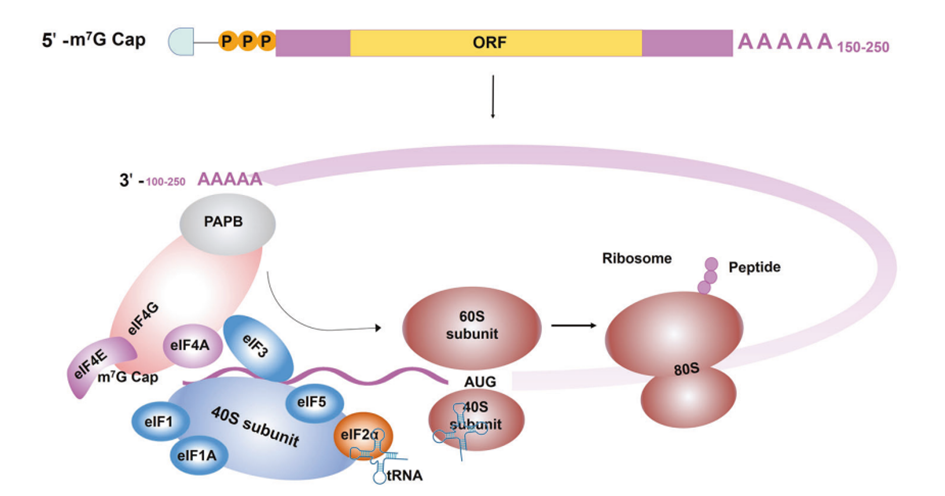
图3体内mRNA翻译起始阶段
5’-UTR和3’-UTR:mRNA的3’和5’端UTR并不直接编码蛋白质,但在调节mRNA的翻译和蛋白表达中发挥重要作用。UTR参与mRNA的亚细胞定位,调节翻译效率和mRNA的稳定性。5’-UTR和3’-UTR均调节蛋白表达水平,5’-UTR主要参与翻译过程的启动,而3’-UTR主要影响mRNA的稳定性和半衰期。5’帽触发核糖体结合,随后在翻译过程中识别蛋白质合成的起始序列。此外,5’-UTR的内部核糖体进入位点也可以招募核糖体,并以帽和eIF4e独立的方式启动翻译。研究表明5’-UTR根据系统和细胞类型调控蛋白质表达。
ORF:ORF的设计主要集中在密码子的优化、功能肽的引入以及复制过程。密码子优化是一种广泛使用但有争议的改进方法。用ORF中丰度较高的tRNA解码的同义密码子替换稀有密码子,提高了mRNA的翻译效率,但它可能改变蛋白质构象,产生体内生物活性未知的新肽。通过替换ORF中的稀有密码子来增加GC含量,可以保护mRNA免受核糖核酸内切酶的降解,并提高体内mRNA蛋白的表达。此外,功能肽对mRNA药物至关重要,mRNA编码的信号肽是细胞外发挥功能的蛋白质所必需的,因此,需要通过向ORF区域引入信号肽来优化mRNA,以改善治疗性mRNA的功能。研究表明通过编码ORF中的分泌信号和MHC I分子的跨膜胞质结构域,改善了蛋白抗原的运输特性,使DCs中的抗原呈递率提高了10倍,提高了mRNA疫苗在小鼠体内的抗肿瘤效果。
总之,每一步mRNA的质量控制直接关系到其疗效,因此,mRNA的生产和制备是基于mRNA治疗的关键。
02 mRNA制造
mRNA的合成和优化:IVT mRNA是用线性化质粒DNA模板或PCR模板进行的,至少需要一个启动子和相应的mRNA构建序列。IVT mRNA通过添加聚合酶(T7, T3或SP6)来进行,但需要额外加帽,无帽mRNA可被RNase快速降解,并包含一个5’-ppp基团,可引起更大的免疫刺激,可用磷酸酶治疗以降低不良疗效。对IVT mRNA的加帽有两种方法:共转录加帽和转录后加帽。
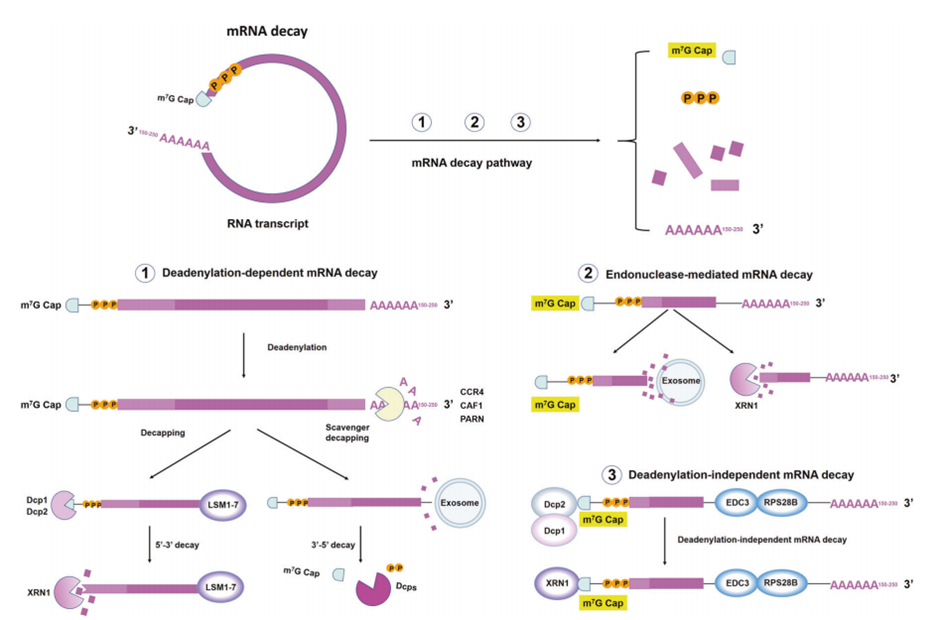
图4 mRNA衰变机制
IVT mRNA的Poly (A)尾巴通常被编码在DNA模板中,或通过多腺苷酸化附着在IVT mRNA上,前者对Poly (A)尾巴的长度控制更为精确。值得注意的是,用于质粒模板线性化的II型限制性内切酶会促进3’突出,阻碍了IVT mRNA的翻译效果,这需要通过用IIS型限制性内切酶取代II型限制性内切酶来避免。
mRNA纯化:IVT mRNA在合成后与RNA聚合酶和DNA模板混合,因此,纯化IVT mRNA至关重要,包括去除免疫刺激污染物、游离核糖核苷酸、短mRNA和DNA模板。通常,DNase用于降解多余的DNA模板。通常使用商业纯化试剂盒对合成的mRNA进行纯化和分离,然后用乙醇或异丙醇沉淀,可以去除大部分污染物,获得高纯度的mRNA,然后用高浓度的LiCl或醇基沉淀法、色谱法或从硅膜柱中洗脱mRNA,去除蛋白质、游离核苷酸或其他成分,但不能去除dsRNA杂质。
RNase III是一种新的纯化方法,已被提出可以消除dsRNA污染物,并被证明可以显著降低mRNA的免疫原性,通过电穿孔RNAaseIII来降低mRNA的免疫原性,可以提高CAR-T细胞的细胞毒性杀伤效果。其潜在的缺点是RNase III可能会切割由单链RNA形成的双链二级结构。
根据研究或应用目的可以选择多种方法纯化不同纯度要求和规模的mRNA,无论使用哪种方法进行纯化,严格的mRNA质量控制标准都是确保mRNA治疗的效益最大化的核心。
结 语
基于mRNA的治疗方法有望成为各种难治性疾病的有效治疗方法,包括传染病、代谢性遗传疾病、癌症、心脑血管疾病和其他疾病。大量研究表明,mRNA不仅介导更好的转染效率和更长的蛋白质表达,而且比DNA和传统蛋白质药物具有更大的优势,mRNA已经成为药物开发中最有吸引力的领域之一[3]。
参考资料:
[1]Boczkowski D, Nair SK, Snyder D, Gilboa E. Dendritic cells pulsed with RNA are potent antigen-presenting cells in vitro and in vivo. J Exp Med. 1996 Aug 1;184(2):465-72.
[2] Wadhwa A, Aljabbari A, Lokras A, Foged C, Thakur A. Opportunities and Challenges in the Delivery of mRNA-based Vaccines. Pharmaceutics. 2020 Jan 28;12(2):102.
[3] Qin S, Tang X, Chen Y, Chen K, Fan N, Xiao W, Zheng Q, Li G, Teng Y, Wu M, Song X. mRNA-based therapeutics: powerful and versatile tools to combat diseases. Signal Transduct Target Ther. 2022 May 21;7(1):166.














